Postpartale Hämorrhagie
01.02.24 - Aktualisiertes PPH-Schema mit u.a. Celox und Vakuum-Tamponade
27.10.23 - Metrastop-Katheter als Bakri-Katheter-Ersatz
02.12.22 - Dosierungsangabe hinzugefügt
01.12.22 - Amendment Sursee eingesetzt
09.06.22 - Gabe von Pabal und Cyklokapron zur Prophylaxe bei vaginaler Geburt mit erhöhtem PPH-Risiko
20.05.22 - Ablassen und Entfernung des Bakrikatheters von der Situation abhängig, immer in Rücksprache mit ärtzlichem Dienst
10.03.22 - Ab Blutverlust 800 ml immer Anästhesie informieren und 2. venösen Zugang legen
14.07.20 - Patientinnen mit arteriellem Zugang müssen zwingend im Aufwachraum oder auf der ZIM überwacht werden
WHO:
- Blutverlust > 500 ml nach der Entwicklung des Kindes
- Blutverlust > 1000 ml = Schwere postpartale Hämorrhagie
AWMF:
- Blutverlust von ≥ 500 ml nach vaginaler Geburt
- Blutverlust von ≥ 1000 ml nach Sectio caesarea
Die Mehrzahl der Patientinnen, die eine PPH entwickeln, haben keine Risikofaktoren
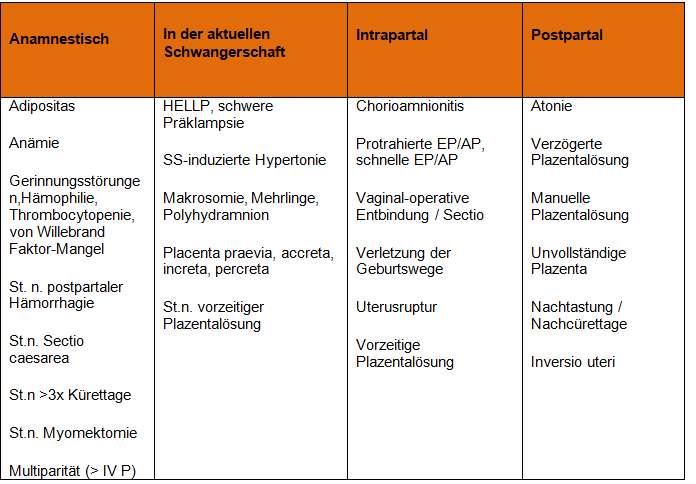
Folgende präpartale Labordiagnostik sollte erhoben werden: Hg1, aPTT, Fibrinogen.
Bei peripartalen Blutungen ist unabhängig von der Therapie die Fibrinogenbestimmung angezeigt. Normalwert Fibrinogen für Schwangere: 3.5 bis 6.5 g/L. Die Fibrinogenspiegel fallen in der DIC.
Der negativ prädiktive Wert von Fibrinogenkonzentration >4g/l lag in einer prospektiven Studie (n=128) bei 79 %, der positive prädiktive Wert für PPH betrug bei einer Fibrinogenkonzentration <2g/l 100 %.
Bei auffälliger Gerinnungs- bzw. Blutungsanamnese unklarer Ursache sollten neben dem Blutbild und den plasmatischen Gerinnungswerten zusätzlich die Thrombozytenfunktion, eine von Willebrand-Diagnostik (Ristocetin Co-Faktor, von Willebrand-Faktor, Faktor VIII, von Willebrand-Antigen) und ggf. der Faktor XIII präpartal bestimmt werden.
Von Willebrand-Faktor und der Faktor VIII werden in der Schwangerschaft hochreguliert. Somit kann ein präexistentes von Willebrand-Syndrom Typ I in der Schwangerschaft physiologisch kompensiert sein und nur erschwert diagnostiziert werden.
Bei Vorliegen von hämatologischen Erkrankungen (Gerinnungsstörung, Blutungsanamnese, positiver Antikörpersuchtest) präpartale Vorstellung bei Hämatologen und allfällige präpartale Bereitstellung spezifischer Medikamente z.B Minirin (in Gebärsaal im Kühlschrank vorrätig), Faktor VIII (Haemate®) und Bereitstellung gekreuzter EC. Dies erfolgt über einen schriftlichen Eintrag (Pränatalboard) anlässlich der Triage der Geburtsanmeldung.
Patient Blood Management: Die interdisziplinäre Optimierung der Anämie beginnt bereits präpartal- intrapartal- intraoperativ:
-
Bei auffälliger Gerinnungs- bzw. Blutungsanamnese präpartale Abklärung einer Hämostase- oder Gerinnungsstörung zusammen mit der Hämatologie. Auffällige Anamnese: Schleimhautblutungen, Zahnfleischblutungen, Epistaxis, oberflächliche Hämatome, Menorhagien (kann während 1-3 Tagen nicht aus dem Haus, trage Schwarze Hosen), rez. Fe-Mangel, postoperative Nachblutungen
- Screening auf Plazenta Increta Spektrum bei Vorliegen von anamnestischen Risikofaktoren im Rahmen des 1. und 2. Screening.
- Vorliegen von Type & Screen bei Eintritt zur Geburt. Information an Anästhesie bei positivem Antikörpersuchtest
- Beachtung der Richtzeiten EP/AP mit Anlage eines Partogramm ab Cervixdilatation 4 cm
- Aktives Management der Plazentarperiode
- Gabe von Carbetocin (Pabal®) 100 µg/ml i.v bei der Sectio als einmalige Dosis langsam über 1 Minute unmittelbar nach Abnabelung des Kindes. Es sollte keine zweite Dosis Pabal verabreicht werden.
- Gabe von Carbetocin (Pabal®) 100 µg/ml i.v bei vaginalem Partus mit erhöhtem Risiko für eine PPH (St.n. PPH, bekannte Gerinnungsstörung, situativ auch bei Schätzgewicht > 4000g, lange Austreibungsperiode oder Multiparität) als einmalige Dosis langsam über 1 Minute sowie Cyklokapron® 1g i.v. unmittelbar nach Abnabelung des Kindes. Die Gabe von Pabal® und Cyklokapron® nach vaginalem Partus erfolgt nach Rücksprache mit dem diensthabenden ärztlichen Gebärsaalteam. Es sollte keine zweite Dosis Pabal® verabreicht werden.
- Zum Ausgleich eines mitunter massiven Blutverlustes im Rahmen einer PPH sollte ein Massivtransfusionsgerät ("rapid infusor") in der Nähe zur Verfügung stehen.
- Autotransfusion („cell saver“) zur Vermeidung / Reduktion einer Massentransfusion bei Sectio mit hohem Blutungsrisiko (z.B. Plazentaimplantationsstörungen) ist am OP Tisch parat.
- Erste Massnahmen:
- Ressourcen optimieren: 2. Hebamme, Oberarzt Gebärsaal
- Ab 800 ml Blutverlust muss die Anästhesie (Oberarzt Tagdienst Tel 1535, Oberarzt Nacht- / Wochenenddienst Tel 1500) immer informiert werden
- Kontinuierliche Vitalzeichen (BD, Puls, O2-Sättigung)
- Volumenersatz (siehe unten)
- Harnblase leeren, Dauerkatheter
- Zwei venöse grosslumige Zugänge ab 800 ml Blutverlust
- Bestimmung Hb-Ausgangswert, Type & Screen
- EC bestellen (2-4 Stück)
- Kontinuierliche Uteruskompression bzw. Massage, Eisblase
- 5 IE Syntocinon® in Kurzinfusion i.v. ("2. Syntocinon®-Bolus") gefolgt von 20 IE Syntocinon® in 1000 ml Ringerfundin
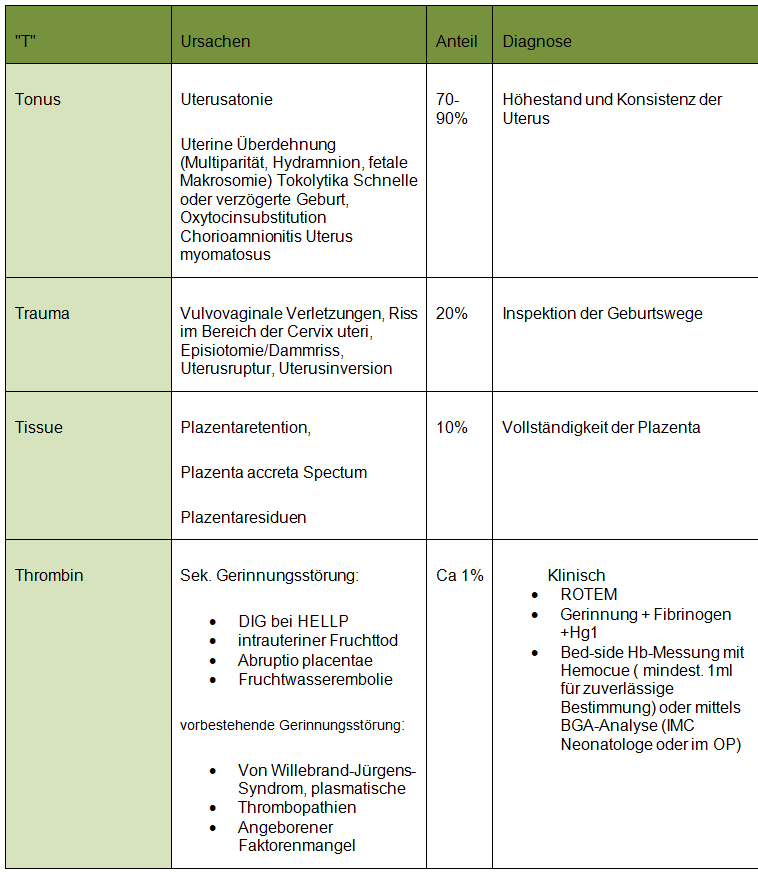
B. Parallel dazu: Blutungsursache feststellen 4 "T"
- Inspektion der Geburtswege mit breiten Spekula in Trendelenburg in optimale Lagerung und mit Assistenz.
- Plazentainspektion
- Sonographische Kontrolle des Cavum uteri: Restmaterial? Koagel
C. Volumenersatz:
- Ringerfundin (kristalloides Volumenersatzmittel): 1. Wahl
- Physiogel (kolloidales Volumenersatzmittel) 2. Wahl. Es kann schwere allergische Reaktionen auslösen.
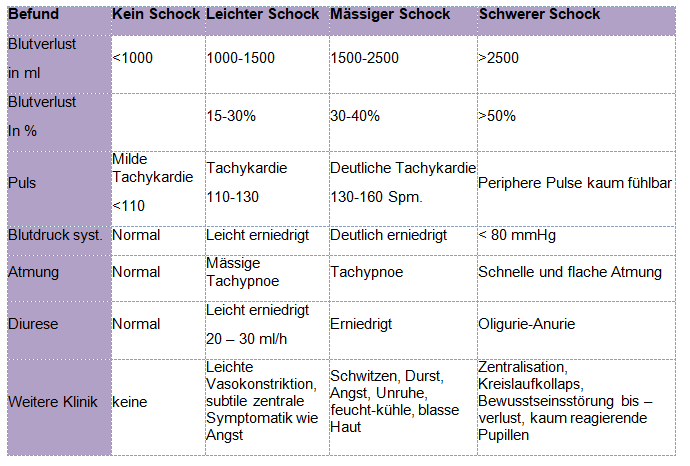
Klinische Zeichen des Volumenmangelschocks
D. Massnahmen bei Plazentaretention
- Credé-Handgriff
- Kompression von Geburtsverletzungen/Episiotomien evt. mit Gefässklemmen
- Nur bei leichter vaginalen Blutung: 3 Tabletten Cytotec® à 200 μg rektal (CAVE: Wirkungseintritt erst nach 30 Min.) Nebenwirkungen: Shivering, Temperaturanstieg, Diarrhoe.
- manuelle Plazentalösung, Nachkürettage. In dem Fall Antibiotikaprophylaxe als Single shot mit 2 gr. Kefzol i.v. oder bei Penicillinallergie: Clindamycin 900 mg i.v. Single shot
- Mechanische Massnahmen: Massage des Uterus (endogene Prostaglandinbildung), bimanuelle Uteruskompression (z.B. Hamilton Manöver Abbildung 1 )
(1) Hamilton-Manöver
E. Massnahmen bei Inversio uteri
Eine Uterusinversion kann sowohl bei vaginaler Geburt als auch bei Sectio (durch die Uterotomie) auftreten
Klinik und Diagnostik:
- Abdominale Palpation: fehlender Funduswiderstand, ggf. tassenförmige Einstülpung tastbar
- Bei unklarem Befund: Ultraschalluntersuchung
Therapie:
Ziel ist die Reposition des Uterus sowie die Behandlung der blutungsbedingten Schocksymptomatik; die folgenden Maßnahmen sollen sofort nach Diagnosestellung in dieser Reihenfolge durchgeführt werden:
- Beendigung der Uterotonikagabe
- Zuziehen geburtshilflicher Facharzt und Anästhesie
- Schaffung adäquater, intravenöser Zugänge, Volumensubstitution
- Kein Versuch einer Plazentaentfernung, diese soll wegen des erhöhten Blutverlustes, falls möglich (Placenta accreta) erst nach Reposition entfernt werden
- Versuch einer Repositionierung des Fundus (Johnson Manöver Abbildung 2)
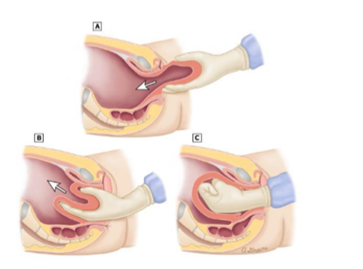
(2):Johnson-Manöver: Reposition des Uterus
- Falls frustran, Gabe von Uterusrelaxantien (z.B. Nitroglycerin 50 µg i.v.,Betamimetika) und neuerlicher Repositionsversuch mittels Johnson Manöver
- Falls weiter frustran : Laparotomie und Huntington-Manöver, ggf. simultan Johnson Manöver; falls frustran, Durchführung des Haultain-Manövers
(3): Huntington-Manöver
(4): Haultain-Manöver
- Nach Reposition Uterotonikagabe (z.B. Oxytozin)
- Antibiotische Abschirmung
1. Oxytocin ( Syntocinon®)
- 5 IE (1 Amp.) Syntocinon® in 100 ml NaCl 0.9% als Kurzinfusion ("2. Syntocinon®-Bolus") gefolgt von 20 IE Syntocinon® in 1000 ml Ringerfundin als Dauertropfinfusion (Dosis abhängig von uteriner Wirkung)
- Bei deutlicher Atonie 20 IE Syntocinon® in 1000 ml Ringerfundin in vollem Strahl für 10 Minuten laufen lassen, danach bei stabiler Blutung reduzieren
Cave:
- Rezeptorsättigung bei langanhaltender Oxytocin-Gabe zur Wehenunterstützung.
- Reflextachykardie, Erhöhung des Herzminutenvolumens, vorübergehender Abfall des arteriellen Blutdrucks. CAVE: Bei mütterlicher Hypotension und kardiovaskulärer Erkrankung; Myokardischämie und Todesfälle beschrieben.
- Keine Oxytocin-Gabe nach zuvor erfolgter Carbetocin (Pabal®)-Gabe.
2. Misoprostol (Cytotec®): nur bei leichter PPH <1000 ml
- 800-1000 µg Misoprostol rektal oder 600 µg oral (sublingual) Einmaldosis.
- Nebenwirkungen: Schwindel, Kopfschmerzen, Temperaturanstieg, Zittern (Shivering)
- Kontraindikationen: Bekannte Überempfindlichkeit gegen Misoprostol, andere Inhaltsstoffe oder Prostaglandine
- Cave: Wirkungseintritt erst nach 30 Minuten
3. Tranexamsäure (Cyklokapron®)
- Kann auch von Dienstarzt allein verordnet werden
- Tranexamsäure (Cyklokapron®) initial 1-2 g (15-30 mg/kgKG), b.B. Wiederholung
- immer vor Fibrinogengabe
- Nebenwirkung: Kopfschmerzen, Schwindel, Übelkeit, Erbrechen, Diarrhoe, abdominale Schmerzen
4. Sulproston (Nalador®)
- Cave: Syntocinon®-Infusion stoppen! keine Syntocinon-Gabe parallel
- Nalador®-Gabe immer über Infusomat
- Überwachung von Atmung und Kreislauf
- maximale Gesamtdosis: 3 Ampullen (1500 µg)
Dosis
500 ml NaCl 0.9% mit 1 Ampulle Nalador® à 500 µg
Im klinischen Management der PPH hat sich folgendes deeskalierende Schema der Nalador®-Gabe als sinnvoll erwiesen:
Deeskalierende Laufgeschwindigkeit, d.h.:
- 3 min mit 500 ml/h bzw. 8,3 ml/min (500 µg/h bzw. 8,3 μg/min), dann
- 7 min mit 100 ml/h bzw. 1,7 ml/min (100 µg/h bzw. 1,7 μg/min),
- dann weiter mit 20 ml/h bzw. 0,4 ml/min
- In der Regel kann die Nalador®-Applikation nach ca. 6 h nach Therapiebeginn beendet werden
Ultimative Dosis für maximal 30 Minuten, falls es weiter blutet (off label)
- 1000 ml/h bzw. 16.7 ml/min (1000 µg/h bzw. 16.7 µg/min)
- Bei Blutungsstillstand Dosis alle 30 Minuten reduzieren.
- Cave: ausschleichen langsam
Nebenwirkungen: Übelkeit, Erbrechen, Darmspasmen, Hyperthermie, sehr selten Bradykardien und/oder Blutdruckabfall. in Einzelfällen Myokardischämien mit nachfolgendem Myokardinfarkt, Hypertensive Krise, Ventrikuläre Tachykardie, Kammerflimmern, Druckerhöhung im Lungenkreislauf, Lungenödem.
Relative Kontraindikationen: schwere kardiale Ischämie, schwerstes Asthma bronchiale, Schwere Hypertonie, Schwere Leber-oder Nierenfunktionsstörung, Thalassämie, Sichelzellenanämie. Vorsicht bei Alter >35 J.
5. Erytrozytenkonzentrate
Bei weiterbestehender starker Blutung und Hb <7 g/dl. Erytrozytenkonzentrate müssen blutgruppenkompatibel sein.
- 6. Gerinnungsfaktoren
- ROTEM-gesteuerte Substitution von Gerinnungsfaktoren (Fibrinogen, FFP, PPSB, Faktor XIII) in Absprache mit Anästhesiologie.
- FFP 20 (eher 30) ml/kgKG oder / und Fibrinogen (Haemocomplettan®) (2-)4(-8) g (30-60 mg/kgKG) Ziel: 200 mg/dl bzw 2,0 g/l FFP sollte blutgruppenkompatibel sein.
- Ratio FFP : EK bei massiver Blutung 2:1
- Fibrinogen-Spiegel < 2,0 g/L unter der Geburt sind als hoch prädiktiver Risikofaktor für das Fortschreiten der verstärkten peripartalen Blutung zu werten und sollten bei Nachweis von klinischen Blutungszeichen behandelt werden. Sind jedoch keine Zeichen einer aktiven Blutung nachweisbar, so ist eine Behandlung mit Haemocomplettan® meist nicht notwendig, da Fibrinogen innerhalb von 24 Stunden neu synthetisiert wird.
- PPSB (Prothrombinkonzentrat) initial 1.000-2.500 IE (25 IE/kgKG)
- FFP sollte blutgruppenkompatibel sein.
- ggf. 1-2x Faktor XIII (Fibrogammin®) 1.250 IE (15-20 IE/kgKG)
- DDAVP Desmopressin (Minirin®)0,3 µg/kgKG über 30 Minuten (1 Ampulle pro 10 kgKG über 30 min)
Von Willebrand-Faktor und der Faktor VIII werden in der Schwangerschaft hochreguliert. Somit kann ein präexistentes von Willebrand-Syndrom Typ I als Ursache einer in der Schwangerschaft physiologisch kompensiert sein und nur erschwert diagnostiziert werden. Erniedrigte Werte im Rahmen der von Willebrand-Diagnostik können hinweisgebend sein, im Falle einer Blutung unter der Geburt frühzeitig auch an die Gabe von Desmopressin zu denken.
- 7.Thrombozytenkonzentrate
Thrombozytenkonzentrate sollten blutgruppenkompatibel sein
8. Novoseven® rFVIIa: ultima ratio
- Blutgerinnungsfaktor VIIa, rekombinant
- im Einzelfall & bei Erfolglosigkeit aller anderen Therapieoptionen initial 90 µg/kgKG
- Rücksprache mit Dienstarzt Hämatologie, Telefon 97 1385 sowie Anästhesiologie
- während Blutung kein Antithrombin (ATIII), ggf. nach PPSB-Gabe und Blutungsende erwägen
- während Blutung kein Heparin
- CAVE: Innerhalb von 24 Stunden nach Beendigung der zur Blutung führenden Pathologie ist eine Thromboseprophylaxe obligat!
- Nebenwirkungen: Fieber und Ausschlag und die schwerwiegenden UAW sind thromboembolische Ereignisse (selten).
- Kosten! 1 mg (907.55 CHF) 5 mg (4370.80 CHF)
G. Intrauterine Tamponade
Celox®
- Mit Chitosan überzogene Gaze
- Chitosan ist ein hydrophiles Biopolymer welches aus Krustentieren gewonnen wird und hervorragende hämostatische Eigenschaften zeigt. Zudem zeigt es antibakterielle Eigenschaften
- Kann gemäss Hersteller bei Meeresfrüchte-Allergie verwendet werden
- Einlage in der Regel von vaginal (per Hand oder mit Klemme), kann bei Sectio aber auch transabdominal über die Uterotomie eingeführt werden
- Celox® ist nicht resorbierbar und muss immer entfernt werden (frühestens 6 Stunden, spätestens 24 Stunden nach Einlage), daher
- Bei der Einlage nie Celox® zerschneiden
- Immer darauf achten, dass vaginal die untere Extremität der Celox®-Gaze herausragt, ggf. mit Faden markieren.
- Gleichzeitige Applikation von Nalador möglich
- Gleichzeitige Anwendung einer intrauterinen Ballontamponande (Bakri oder Metrastop, siehe unten) möglich
Bakri®
- max. mit 500 ml NaCl 0.9% (möglichst körperwarm) füllen
- Kann bei Sectio transabdominal über die Uterotomie eingelegt werden.
- Zusätzlich vaginale Tamponade mit Tüchern, alternativ Cerclage zur intrauterinen Fixierung des Ballons falls sich dieser nach Einlage disloziert
- Entblocken und Entfernung von der Situation abhängig, immer in Rücksprache mit ärtzlichem Dienst
- Video: https://www.youtube.com/watch?v=n1McwrLZ2_I
Intrauterine Vakuum-Tamponade
Verwendung des Bakri®-Katheters mit dem Ziel, einen Unterdruck im Cavum uteri zu erzeugen. Somit wird das intrauterin angesammelte Blut abgesaugt und die myometrane Kontraktion und damit der Verschluss der Spiralarterien unterstützt.
- Einlegen des Ballon-Systems wie üblich
- Auffüllen: Bakri® mit 80-120 ml NaCl 0.9% auffüllen
- Flüssigkeitssammelbeutel ans Drainagelumen anschliessen
- Schlauch des Sammelbeutels durchschneiden
- Das abgeschnittene Ende des Sammelschlauches wird an den Absaugschlauch mithilfe des Verbindungstücks (siehe Bild) angeschlossen

- Absaugschlauch an die Vakuumpumpe anschliessen
- CAVE: die Vakuumpumpe befindet sich hinter dem Gebärsaal-Operationssaal, gegenüber des Überwachungszimmers 1, bitte nicht die für Metallvakuumextraktionen vorgesehenen Pumpen verwenden!
- Vakuupumpe einschalten und Sog auf -80 kPa (-0.8 Bar) aufbauen
- In den meisten Fällen kommt es zum Sistieren der Blutung und zur suffizienten Uteruskontraktion innert Minuten
- Üblicherweise kann nach einer Stunde der Sog abgestellt werden.
- Der Ballon sollte nach Abstellen des Soges intrauterin belassen werden. Falls die Blutung nach mehreren Stunden (4-6 Stunden) weiterhin steht, kann der Ballon entblockt und gezogen werden. Uterototonika werden weiter wie üblich verabreicht
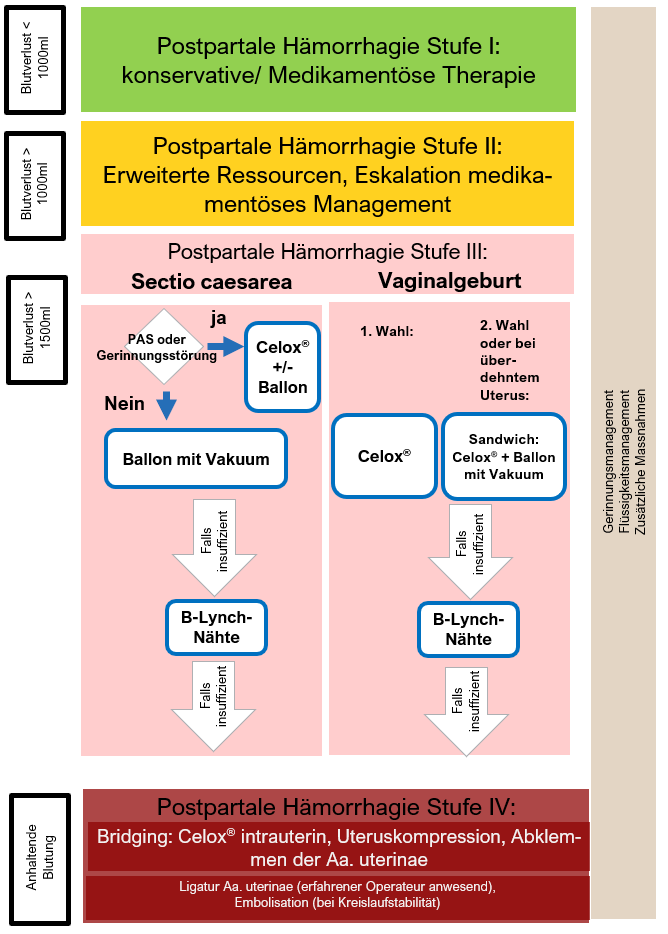
Wahl der Methode der intrauterinen Tamponade
In Bezug auf die intrauterine Tamponade steht es gemäss den aktuellen Leitlinien grundsätzlich jedem Operateur frei, die entsprechende Methode (Celox® , konventionelle Ballon-Tamponade, Vakuumtamponade oder Kombination aus Celox® mit Ballon- bzw. Vakuumtamponade) je nach Verfügbarkeit, klinischer Erfahrung und Situation anzuwenden.
An der Frauenklinik Luzern empfehlen wir ein situationsabhängiges Vorgehen (siehe Flowchart unten), mit dem Ziel, ein möglichst einheitliches Management anzustreben.
H. Chirurgische Massnahmen :
Spätestens hier Information Hintergrunddienst Frauenklinik und Information interventionelle Radiologie zur allfälligen Embolisationsbereitschaft.
Kompressionsnähte
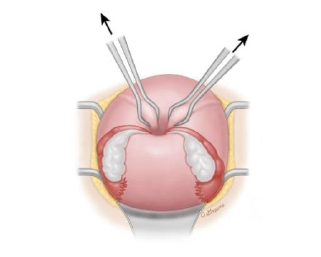
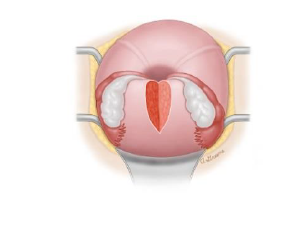
1. B-Lynch-Naht
Kompression des gesamten Uterus inkl. des unteren Uterinsegmentes; Reduktion der uterinen Blutversorgung durch Ligatur der zuführenden Gefäße (Aa. uterinae und Rami uterini der Aa. ovaricae). Longitudinale „Rucksacknaht“ mit Inzision im unteren Uterinsegment.
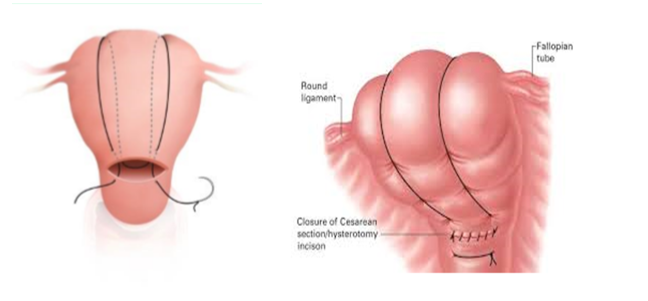
(6) B-Lynch-Nähte
2.Spaetling Kompressionsnähte:
Kompression der kompletten Uterusvorderwand an die Rückwand vom Fundus bis zur Zervix
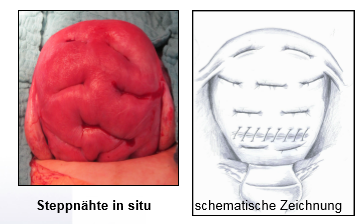
(7) Spätlingnähte aus DGGG Kongress 2012
https://spaetling.net/wp-content/uploads/2015/11/quilting-sutures-IJGO-117_2012_291sig.pdf
3.Pereira Naht : Atonie und Implantationsstörung Mehrfache zirkuläre und longitudinale Nähte ohne Cavumbeteiligung. ( Abbildung 6)
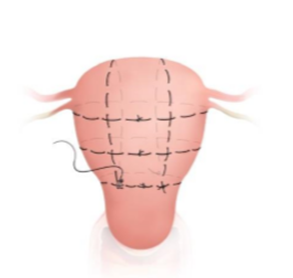
(7) Perreiranähte
4. Abklemmen der Arteria uterina
- Luxieren des Uterus vor die Bauchdecke
- Eröffnen des Ligamentum latums 2 cm kaudal des Lig. rotundum
- Setzen einer langen geraden Klemme parallel des Uterus bis zum Isthmus und Abklemmen der Arteriae uterinae beidseits
- Somit bleibt der Uterus-Adnex-Komplex erhalten
5. Ligatur der Arteriae uterinae, ein- oder beidseitig
Nur durch ein in der Beckenchirurgie erfahrenen Operateur erfolgen.
- Freilegung der Arteria iliaca interna über 3-4 cm
- dann doppelte Unterbindung der Arteria uterina distal des dorsalen Hauptastes – ca. 2,5 cm hinter der Bifurkation
- keine Durchtrennung des Gefässes
- Vor der Ligatur müssen der Ureter, die Aa. iliacae externae und communes sowie die Vv. iliacae internae identifiziert werden.
6. Ligatur der Arteria iliaca interna
7.Hysterektomie
Bei Atonie und klarer Demarkation zwischen Corpus- und Cervix ist eine ist die suprazervikale Hysterektomie zu bevorzugen. Bei St.n. Sektio kann dies erwert sein, dann ggf, totale Hysterektomie. Bei Plazentaimplantationsstörungen im unteren Uterinsegment ist die totale Hysterektomie mit Darstellung der Ureteren anzuraten.
8. Embolisation: Notfallmässige interventionelle Embolisation der Aa. uterinae bei postpartalen Blutungen
I. Flankierende Maßnahmen bei schwerer PPH:
- Kerntemperatur > 34°C (möglichst Normothermie)
- pH-Wert >7,2
- ionisierte Ca++-Konzentration >0,9 mmol/l (möglichst Normokalzämie)
-
Arterieller Zugang
Patientinnen mit einem arteriellen Zugang müssen im Aufwachraum oder auf der ZIM überwacht werden und dürfen nicht in die Gebärabteilung verlegt werden. Der Gebärsaal verfügt nicht über die entsprechenden nötigen Überwachungsmöglichkeiten.
Abkürzungen:
DIC Disseminierte intravasale Gerinnung
FFP fresh frozen plasma
PPSB Prothrombinkonzentrat, z.B. Beriplex® oder Prothromplex®
DDAVP Desmopressin (Minirin®)
Faktor XIII Fibrogammin®
Fibrinogen Haemocomplettan®
AWMF Arbeitsgemeinschaft d. Wissenschaftl. Med.
Fachgesellschaften
Referenzen:
- AWMF S2k-Leitlinie 08/2022 Peripartale Blutungen, Diagnostik und Therapie
- AWMF S1-Leitlinie 03/2020 Die geburtshilfliche Analgesie und Anästhesie
- Prevention and Management of Postpartum Haemorrhage: Green-top Guideline No. 52. (2017). BJOG, 124(5), e106–e149. https://doi.org/10.1111/1471-0528.14178
- Committee on Practice Bulletins-Obstetrics (2017). Practice Bulletin No. 183: Postpartum Hemorrhage. Obstetrics and gynecology, 130(4), e168–e186. https://doi.org/10.1097/AOG.0000000000002351
- Waibel KH, Haney B, Moore M, Whisman B, Gomez R. Safety of chitosan bandages in shellfish allergic patients. Mil Med. 2011 Oct;176(10):1153-6. doi: 10.7205/milmed-d-11-00150. PMID: 22128651.
- Biele C, Radtke L, Kaufner L, Hinkson L, Braun T, Henrich W, Dückelmann AM. Does the use of chitosan covered gauze for postpartum hemorrhage reduce the need for surgical therapy including hysterectomy? A databased historical cohort study. J Perinat Med. 2022 May 25;50(8):1078-1086. doi: 10.1515/jpm-2021-0533. PMID: 35611816.
- Schmid BC, Rezniczek GA, Rolf N, Saade G, Gebauer G, Maul H. Uterine packing with chitosan-covered gauze for control of postpartum hemorrhage. Am J Obstet Gynecol. 2013 Sep;209(3):225.e1-5. doi: 10.1016/j.ajog.2013.05.055. Epub 2013 May 30. PMID: 23727525.
- Dueckelmann AM, Hinkson L, Nonnenmacher A, Siedentopf JP, Schoenborn I, Weizsaecker K, Kaufner L, Henrich W, Braun T. Uterine packing with chitosan-covered gauze compared to balloon tamponade for managing postpartum hemorrhage. Eur J Obstet Gynecol Reprod Biol. 2019 Sep;240:151-155. doi: 10.1016/j.ejogrb.2019.06.003. Epub 2019 Jun 18. PMID: 31284089.
- Suarez S, Conde-Agudelo A, Borovac-Pinheiro A, Suarez-Rebling D, Eckardt M, Theron G, Burke TF. Uterine balloon tamponade for the treatment of postpartum hemorrhage: a systematic review and meta-analysis. Am J Obstet Gynecol. 2020 Apr;222(4):293.e1-293.e52. doi: 10.1016/j.ajog.2019.11.1287. Epub 2020 Jan 6. PMID: 31917139.
- Wright CE, Chauhan SP, Abuhamad AZ. Bakri balloon in the management of postpartum hemorrhage: a review. Am J Perinatol. 2014 Nov;31(11):957-64. doi: 10.1055/s-0034-1372422. Epub 2014 Apr 4. PMID: 24705972.
- Dorkham MC, Epee-Bekima MJ, Sylvester HC, White SW. Experience of Bakri balloon tamponade at a single tertiary centre: a retrospective case series. J Obstet Gynaecol. 2021 Aug;41(6):854-859. doi: 10.1080/01443615.2020.1799341. Epub 2020 Oct 16. PMID: 33063565.
- Samartha Ram, H., H. S. Shankar Ram, and V. Panicker. "Vacuum retraction of uterus for the management of atonic postpartum hemorrhage." IOSR J Dent Med Sci (IOSR-JDMS) (2014): 2279-0853.
- Purwosunu, Yuditiya, Widyastuti Sarkoen, Sabaratnam Arulkumaran, and Jan Segnitz. "Control of postpartum hemorrhage using vacuum-induced uterine tamponade." Obstetrics & Gynecology 128, no. 1 (2016): 33-36.
- Haslinger, Christian, Kathrin Weber, and Roland Zimmermann. "Vacuum-induced tamponade for treatment of postpartum hemorrhage." Obstetrics and Gynecology 138, no. 3 (2021): 361.
- D’Alton, Mary E., Kara M. Rood, Marcela C. Smid, Hyagriv N. Simhan, Daniel W. Skupski, Akila Subramaniam, Kelly S. Gibson et al. "Intrauterine vacuum-induced hemorrhage-control device for rapid treatment of postpartum hemorrhage." Obstetrics and gynecology 136, no. 5 (2020): 882.
- Goffman D, Rood KM, Bianco A, Biggio JR, Dietz P, Drake K, Heilman E, Hopkins M, De Four Jones M, Katz T, Martin C, Prasad M, Smid MC, Wine KD, Ryan R, Yong C, Carney PI, Simhan HN. Real-World Utilization of an Intrauterine, Vacuum-Induced, Hemorrhage-Control Device. Obstet Gynecol. 2023 Nov 1;142(5):1006-1016. doi: 10.1097/AOG.0000000000005366. Epub 2023 Sep 13. PMID: 37713322.
- Gulersen M, Gerber RP, Rochelson B, Nimaroff M, Jones MDF. Vacuum-Induced Hemorrhage Control versus Uterine Balloon Tamponade for Postpartum Hemorrhage. J Obstet Gynaecol Can. 2023 Apr;45(4):267-272. doi: 10.1016/j.jogc.2023.02.017. Epub 2023 Mar 15. PMID: 36924993.
Bildquellen:
Bilder 1-4 und 6-8 AWMF Leitlinie Peripartale Blutungen...
Bild 5 Clinical Innovations
Bild 7 DGGG 2012
Autoren:
Version 1: M Hodel, 20.01.2015. Version 2: A Vidal, A Winkler 22.05.2020. Version 3 B. Krischer, V. Uerlings 01.02.2024
