Beurteilung von Adnexbefunden mittels IOTA-Kriterien
Inhaltsverzeichnis- Grundlage
- Praktisches Vorgehen
- Flussdiagramm Vorgehen zur Beurteilung und Management von Adnexbefunden
- Dokumentation und praktische Beispiele
- Weiterführende Massnahmen je nach Ergebnis
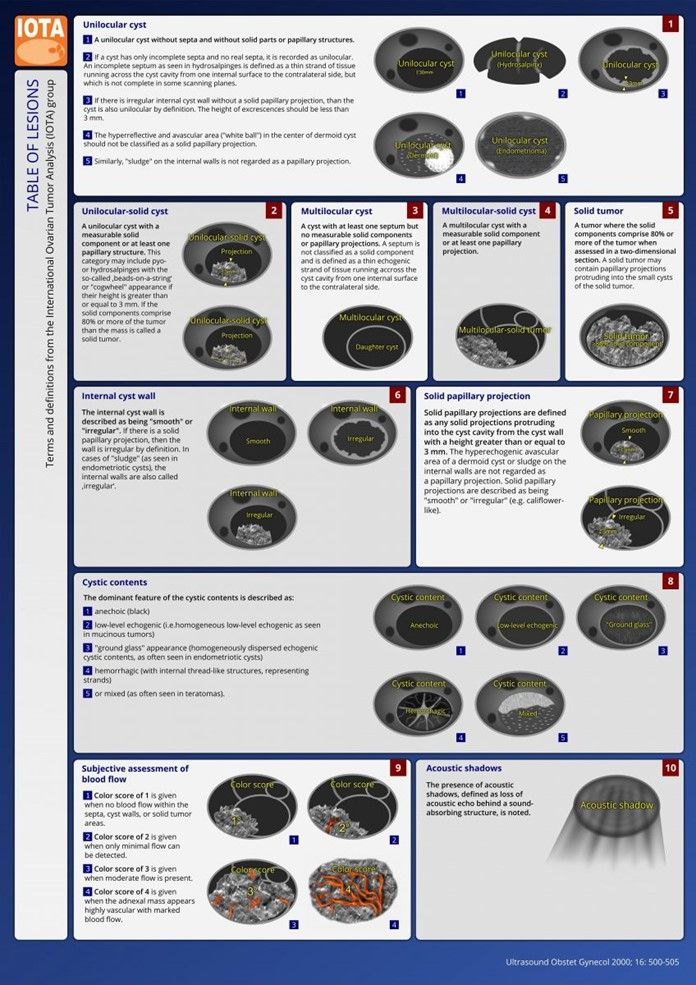
- Anhang 1: Easy Descriptors
- Anhang 2: Simple rules
- Anhang 3: IOTA Nomenklatur
- Literatur
Von der IOTA-Group (www.iotagroup.org) wurden eine standardisierte Nomenklatur und validierte Regeln zur Beschreibung und Beurteilung von Adnexbefunden entwickelt.
Die IOTA-Ansätze zur Klassifizierung von Adnexbefunden wurden validiert und zeigen die beste Test-Performance aller aktuell zur Verfügung stehenden diagnostischen Tools, um zwischen benignen und malignen Prozessen zu unterscheiden.
- Easy descriptors
- Simple rules
- ADNEX-Model
--> Link IOTA Educational Material: Easy Descriptors/Simple Rules/ Nomenklatur
Alle Adnexbefunde, welche im gynäkologischen Ambulatorium gesehen werden, müssen nach diesen Regeln / Kriterien beurteilt und dokumentiert werden.
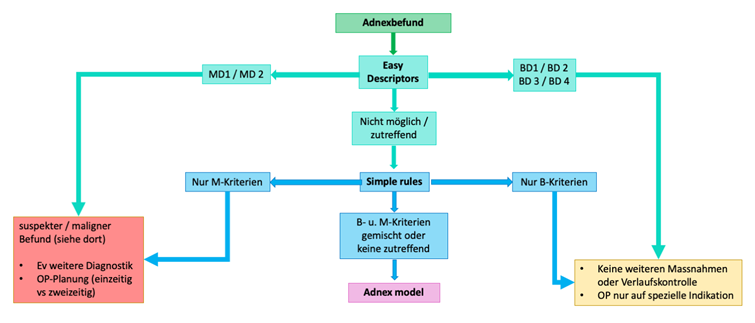
Dabei kommt der 3-Stufen Ansatz zur Anwendung (s. Flussdiagramm):
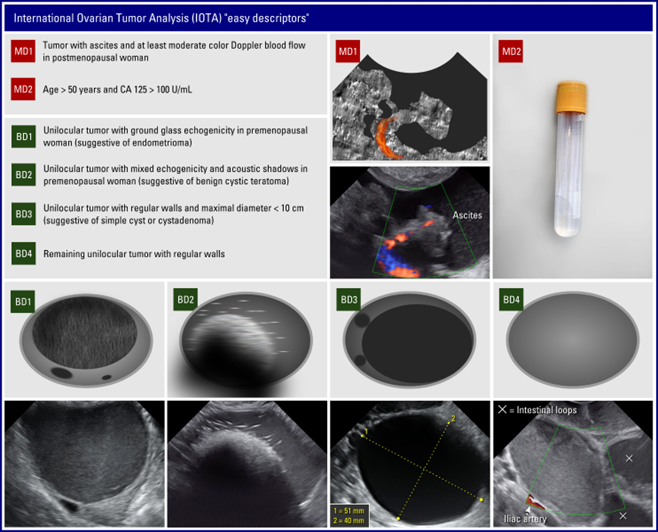
- Versuch, den Befund mittels Easy descriptors (s. Anhang 2) zu klassifizieren (damit können ca. 45% aller Befunde in benigne oder maligne eingeteilt werden, mit einer Sensitivität von 93% und einer Spezifität von 97%)
Falls diese nicht angewendet werden können:
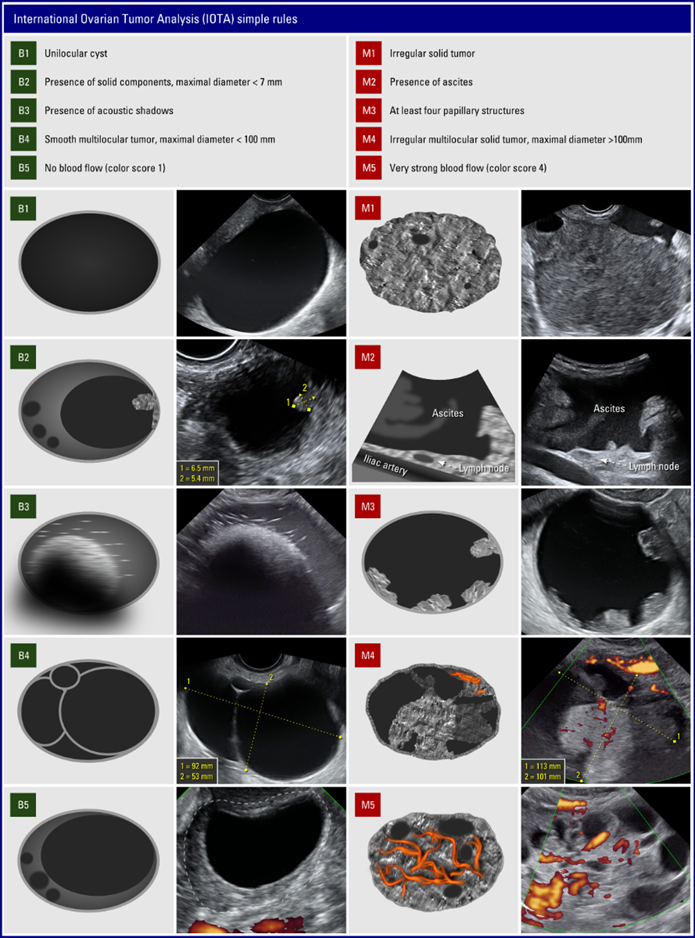
- Versuch den Befund mittels den Simple rules (s. Anhang 2) zu klassifizieren (CAVE die Nomenklatur muss ganz genau beachtet werden (s. Anhang 3)
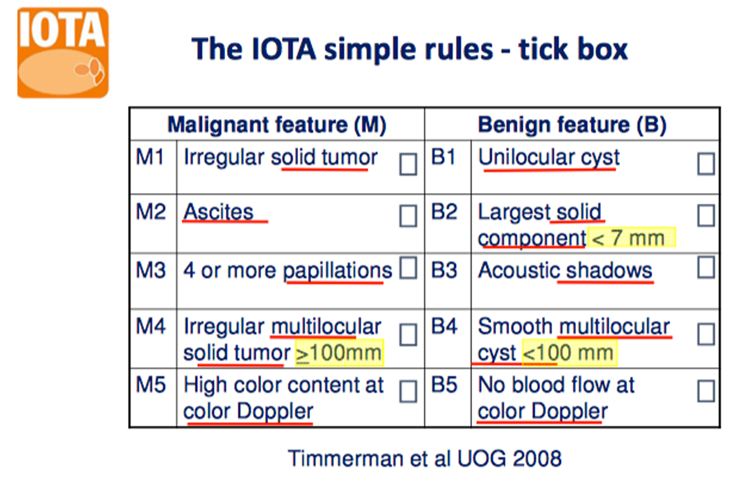
Wenn nur B-Kriterien erfüllt sind => benigne
Wenn nur M-Kriterien erfüllt sind => maligne
Wenn B- und M-Kriterien erfüllt sind => inkonklusiv
Wenn keine Kriterien erfüllt sind => inkonklusiv
(Wenn zuerst die Easy descriptors und dann die simple rules angewendet werden, können ca. 89% aller Adnexbefunde in benigne und maligne eingeteilt werden)
Falls der Befund nach den Simple rules inkonklusiv ist:
3. Anwenden des ADNEX-models. Das ADNEX-model kann nebst der Differenzierung zwischen benignen und malignen Neoplasien auch die Wahrscheinlichkeit für bestimmte Subtypen maligner Befunde voraussagen, was für das klinische Management hochgradig relevant ist.
Risk cut-off
3% => 99% Sensitivität, 43% Spezifität
5% => 98% Sensitivität, 61% Spezifität
10% => 96% Sensitivität, 73% Spezifität

Anwendung: Beschreibung der zutreffenden "easy descriptors" bzw. zutreffenden "simple rules" zusammen mit der möglichen DD in der Diagnoseliste in folgender Weise:
… Adnexbefund (re/li), nach IOTA (benigne / unsicher / maligne), IOTA BD / MD / B / M.... DD: .... / nach Adnex-model Risk of malignancy... %, höchste RR von … für …
Beispiel 1
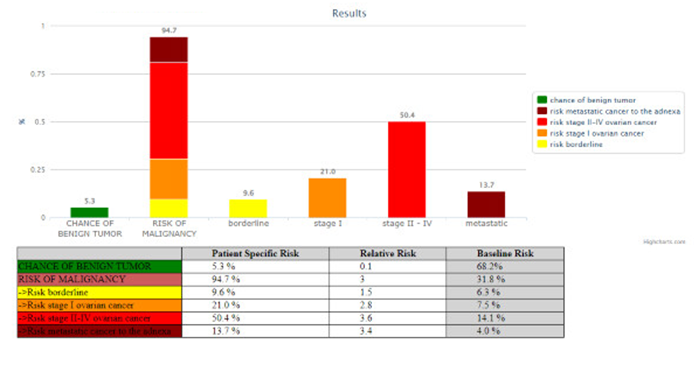
Irregulärer, multiloculär-solider Ovarialtumor rechts, nach IOTA maligne, M5
- nach ADNEX-model Risk of malignancy 94.7%, höchste RR von 3.6 für Stage II-IV ovarian cancer
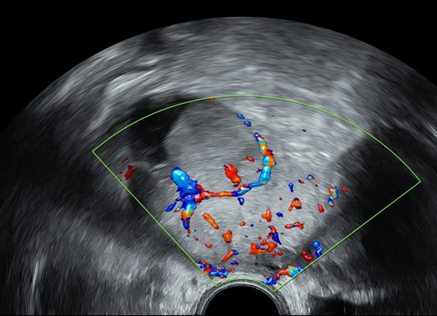
Beispiel 2
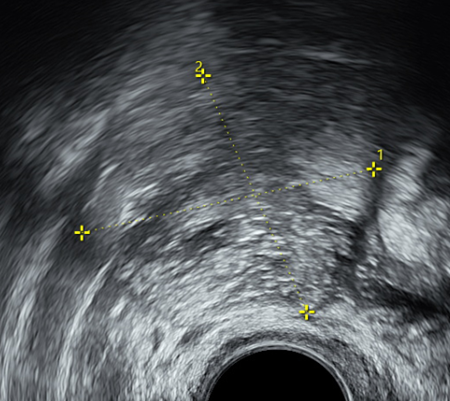
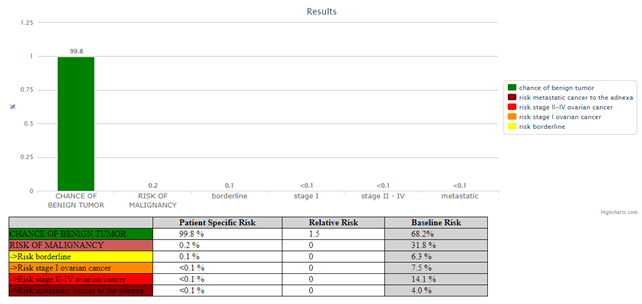
Adnexbefund Ovar rechts, biloculär, mit Inhalt von gemischter Echogenität mit Schallschatten, 48x41x47mm, nach IOTA benigne, BD2, (B4, B5), suggestiv für reifes zystisches Teratom
- nach ADNEX-model Risk of malignancy 0.2%, höchste RR von 1.5 für benign tumor
Im Falle von Adnexbefunden, welche
- nach Easy descriptors in MD1/MD2 eingeteilt werden können
- nach Simple rules nur M-Kriterien aufweisen bzw.
- im ADNEX-model ein erhöhtes Risiko für Malignität aufweisen
=> Zuweisung in gynäkologische Onkologie/Rücksprache Prof. Dr. Brambs
Im Falle von als benigne eingestuften Adnexbefunden
- Zurückhaltende OP-Indikationsstellung; primär beschwerdeorientiert
- Grosszügig konservatives Management wählen mit Verlaufskontrollen inital nach 4 Monaten, anschliessend nach 6-12 Monaten
- Bei Vd.a. Endometriom (nach IOTA BD1) Zuweisung in die Endometriosesprechstunde
- Vorstellung am Gyn-Board (Dienstag, 17:00 Uhr)
2-Jahres Interimsanalyse der IOTA5 multizenter prospektiven Kohortenstudie
Outcome von Patientinnen nach 2 Jahren, welche für ein konservatives Management eines Adnexbefundes, welcher anhand des Ultraschalls für benigne befunden wurde, ausgewählt worden waren (Ultraschall Follow-up nach 3, 6 und anschl. 12 Monaten):
- Spontane Resolution 20.2%
- Malignität 0.4%
- Borderline Malignität 0.3%
- Torsion 0.4%
- Zystenruptur 0.2%
- Welcome | Iota Group
- IOTA - ADNEX model (iotagroup.org)
- Timmerman D, Valentin L, Bourne TH, Collins WP, Verrelst H, Vergote I; International Ovarian Tumor Analysis (IOTA) Group. Terms, definitions and measurements to describe the sonographic features of adnexal tumors: a consensus opinion from the International Ovarian Tumor Analysis (IOTA) Group. Ultrasound Obstet Gynecol. 2000 Oct;16(5):500-5. doi: 10.1046/j.1469-0705.2000.00287.x. PMID: 11169340.
- Timmerman D, Ameye L, Fischerova D, Epstein E, Melis GB, Guerriero S, Van Holsbeke C, Savelli L, Fruscio R, Lissoni AA, Testa AC, Veldman J, Vergote I, Van Huffel S, Bourne T, Valentin L. Simple ultrasound rules to distinguish between benign and malignant adnexal masses before surgery: prospective validation by IOTA group. BMJ. 2010 Dec 14;341:c6839. doi: 10.1136/bmj.c6839. PMID: 21156740; PMCID: PMC3001703.
- Valentin L, Ameye L, Savelli L, Fruscio R, Leone FP, Czekierdowski A, Lissoni AA, Fischerova D, Guerriero S, Van Holsbeke C, Van Huffel S, Timmerman D. Unilocular adnexal cysts with papillary projections but no other solid components: is there a diagnostic method that can classify them reliably as benign or malignant before surgery? Ultrasound Obstet Gynecol. 2013 May;41(5):570-81. doi: 10.1002/uog.12294. Epub 2013 Apr 8. PMID: 22915541.
- Valentin L, Ameye L, Franchi D, Guerriero S, Jurkovic D, Savelli L, Fischerova D, Lissoni A, Van Holsbeke C, Fruscio R, Van Huffel S, Testa A, Timmerman D. Risk of malignancy in unilocular cysts: a study of 1148 adnexal masses classified as unilocular cysts at transvaginal ultrasound and review of the literature. Ultrasound Obstet Gynecol. 2013 Jan;41(1):80-9. doi: 10.1002/uog.12308. Epub 2012 Dec 17. PMID: 23001924.
- Van Calster B, Van Hoorde K, Valentin L, Testa AC, Fischerova D, Van Holsbeke C, Savelli L, Franchi D, Epstein E, Kaijser J, Van Belle V, Czekierdowski A, Guerriero S, Fruscio R, Lanzani C, Scala F, Bourne T, Timmerman D; International Ovarian Tumour Analysis Group. Evaluating the risk of ovarian cancer before surgery using the ADNEX model to differentiate between benign, borderline, early and advanced stage invasive, and secondary metastatic tumours: prospective multicentre diagnostic study. BMJ. 2014 Oct 15;349:g5920. doi: 10.1136/bmj.g5920. PMID: 25320247; PMCID: PMC4198550.
- Van Calster B, Van Hoorde K, Froyman W, Kaijser J, Wynants L, Landolfo C, Anthoulakis C, Vergote I, Bourne T, Timmerman D. Practical guidance for applying the ADNEX model from the IOTA group to discriminate between different subtypes of adnexal tumors. Facts Views Vis Obgyn. 2015;7(1):32-41. PMID: 25897370; PMCID: PMC4402441.
- Timmerman D, Van Calster B, Testa A, Savelli L, Fischerova D, Froyman W, Wynants L, Van Holsbeke C, Epstein E, Franchi D, Kaijser J, Czekierdowski A, Guerriero S, Fruscio R, Leone FPG, Rossi A, Landolfo C, Vergote I, Bourne T, Valentin L. Predicting the risk of malignancy in adnexal masses based on the Simple Rules from the International Ovarian Tumor Analysis group. Am J Obstet Gynecol. 2016 Apr;214(4):424-437. doi: 10.1016/j.ajog.2016.01.007. Epub 2016 Jan 19. PMID: 26800772.
- Sayasneh A, Ferrara L, De Cock B, Saso S, Al-Memar M, Johnson S, Kaijser J, Carvalho J, Husicka R, Smith A, Stalder C, Blanco MC, Ettore G, Van Calster B, Timmerman D, Bourne T. Evaluating the risk of ovarian cancer before surgery using the ADNEX model: a multicentre external validation study. Br J Cancer. 2016 Aug 23;115(5):542-8. doi: 10.1038/bjc.2016.227. Epub 2016 Aug 2. PMID: 27482647; PMCID: PMC4997550.
- Froyman W, Landolfo C, De Cock B, Wynants L, Sladkevicius P, Testa AC, Van Holsbeke C, Domali E, Fruscio R, Epstein E, Dos Santos Bernardo MJ, Franchi D, Kudla MJ, Chiappa V, Alcazar JL, Leone FPG, Buonomo F, Hochberg L, Coccia ME, Guerriero S, Deo N, Jokubkiene L, Kaijser J, Coosemans A, Vergote I, Verbakel JY, Bourne T, Van Calster B, Valentin L, Timmerman D. Risk of complications in patients with conservatively managed ovarian tumours (IOTA5): a 2-year interim analysis of a multicentre, prospective, cohort study. Lancet Oncol. 2019 Mar;20(3):448-458. doi: 10.1016/S1470-2045(18)30837-4. Epub 2019 Feb 5. PMID: 30737137.
- Froyman W, Timmerman D. Methods of Assessing Ovarian Masses: International Ovarian Tumor Analysis Approach. Obstet Gynecol Clin North Am. 2019 Dec;46(4):625-641. doi: 10.1016/j.ogc.2019.07.003. Epub 2019 Sep 25. PMID: 31677746.
Autor: Dr. S. Verta
Autorisiert: Dr. S. Verta
Version: 27.03.2023
Gültig bis: 27.03.2024
