Abnorme uterine Blutungen (neu)
Inhaltsverzeichnis- 1 Definitionen und Klassifikationen
- Palm-COEIN Klassifikation nach FIGO 2011
- 2 Diagnostik bei AUB in der Prämenopause
- 3 Therapieoptionen
- 4 Tamoxifen und Blutungsstörungen
- 5 Literatur
Als abnorme uterine Blutung wird jede uterine Blutung bezeichnet, die nicht auf den normierten Menstruationszyklus zurückzuführen ist. Abweichungen von der Norm können Häufigkeit, Dauer, Zeitpunkt oder Menge der Blutung betreffen.
- Das Risiko für ein Endometriumkarzinom oder eine atypische Endometriumhyperplasie bei prämenopausalen Frauen mit abnormen uterinen Blutungen liegt unter 1,5 %.
- Das Risiko für ein Endometriumkarzinom bei AUB in der Prämenopause beträgt 0,33 %.
- Individuell liegt das Risiko höher für Patientinnen mit Risikofaktoren (BMI, Familienanamnese (Lynch-Syndrom)
Für abnorme uterine Blutungen in der Postmenopause siehe Beitrag: Postmenopausale Blutung:: Obsgyn-Wiki
|
Parameter |
Normal |
Abnormal |
|
Frequenz |
≥24d und ≤ 38d |
Amenorrhoe (primäre Amenorrhoe oder sekundär: Ausbleiben der Menstruation für 6 Monate) |
|
Häufig (<24d) |
||
|
Selten (> 38d) |
||
|
Dauer |
≤ 8d |
Verlängerte Blutung > 8d |
|
Regelmässigkeit |
Regelmässig: Variation zwischen kürzestem und längstem Zyklus ≤ 7 bis 9 Tage |
Unregelmässig: Zyklusdauer variiert ≥ 10 Tage |
|
Blutvolumen |
Durch Patientin als normal empfunden |
Als zu schwach empfunden (<5ml Blutverlust/Zyklus) |
|
Als zu stark empfunden (> 80ml Blutverlust/Zyklus) |
||
|
Intermenstruelle Blutung (Blutungen zwischen dem regelmässigen Zyklus) |
Keine |
Zufällig |
|
Zyklisch (Frühzyklisch, Mitzyklisch, Spätzyklisch) |
Tabelle 1: nach UpToDate: Abnormal uterine bleeding in nonpregnant reproductive-age patients: Terminology, evaluation, and approach to diagnosis - UpToDate (Stand 10.05.2023)
Palm-COEIN Klassifikation nach FIGO 2011
Klassifikation der AUB in der Prämenopause durch FIGO, beschreibt 9 mögliche Ursachen für AUB, sie sollen bei den differenzialdiagnostischen Überlegungen helfen. Zu den PALM-Komponenten zählen strukturelle Ursachen, welche durch Bildgebung/Histologie diagnostiziert werden können, während die COEIN Komponenten die nicht-strukturell bedingten Ursachen zusammenfassen.
|
«PALM»-Komponenten |
«COEIN»-Komponenten |
|
Polyp (AUB-P) Adenomyosis (AUB-A) Leiomyom (AUB-L) Malignom und Hyperplasie (AUB-M) |
Koagulopathie (AUB-C) Ovulationsstörung (AUB-O) Endometriumpathologie (AUB-E) Iatrogene (AUB-I) Nicht klassifizierte (AUB-N) |
Differentialdiagnosen
|
Koagulopathien |
Von-Willebrand-Syndrom Faktormangel (zB. FVIII, FIX) Thrombozytenfunktionsstörung Chronische Leber- oder Nierenerkrankungen |
|
Infektion |
Akute oder chronische Endometritis Zervizitis PID |
|
Ovulationsstörung |
Akut: Follikelpersistenz
Chronisch: Hyperprolaktinämie PCOS Schilddrüsenfunktionsstörungen Mangelernährung, Essstörungen, Stress Weitere DD der Zyklusstörungen |
|
Schwangerschaft |
Abort Plazentarest EUG |
|
Strukturell |
Adenomyose Endometriose Myome Malignität/CIN/Endometriumhyperplasie Polypen Grosse, vulnerable Ektopie |
|
Iatrogen |
Antikoagulantien Psychopharmaka Kupfer-IUD Hormonelle Kontrazeption, Hormontherapie Tamoxifen |
|
Konstitutionell |
Idiopathische Hypermenorrhoe |
|
Varia |
Östrogenproduzierende Tumore Isthmocele AV-Malformationen |
Anamnese
Genaue Zyklusanamnese, Beginn der Blutungsstörungen, Hinweise auf Infektionen, Traumata, vorhergehender GV, Schmerzen bzw. Dysmenorrhoe, Hinweise auf Gerinnungsstörung, Hinweise auf weitere endokrine Störungen, Medikamenteneinnahme (Gerinnungs-beeinflussende Medikamente; Tamoxifen; Hormone), chronische Erkrankungen, Voroperationen, Hinweise auf Hämaturie oder Hämatochezie, Schwangerschaftsanamnese, Risikofaktoren für Endometriumkarzinom, Familienanamnese
Körperliche Untersuchung
Vitalparameter, Temperatur
Hautveränderungen (z.B. Petechien), Androgenisierungszeichen, Galaktorrhoe
Spekuläre Untersuchung
Beurteilung der aktuellen Blutungsmenge, Transformationszone (Ektopieblutung), Tumore, Polypen oder Myome in statu nascendi, Verletzungen, Fremdkörper, ggf. auch Kolposkopie.
Immer Mitbeurteilung von Urethra und Anus.
Nativ, evtl. Abstrichentnahme zervikal (Chlamydien/Gonokokken), evtl. PAP-Abstrich, evtl. Biopsieentnahme
Bimanuelle Untersuchung
Portio-Hebe oder-Schiebeschmerz, Raumforderungen Uterus/Adnexen, Grösse und Mobilität Uterus
Labor
SST im Urin (ggf. bHCG im Serum)
Nach Indikation: Hg1, präoperatives Labor mit T&S, Hormonstatus (Hormonstatus unregelmässig), Gerinnungsanalyse, Leber- und Nierenwerte
Sonographie
Hinweise auf organische Genese (Polyp, Myom, Reste nach Abort/Interruptio, AV-Malformation, Isthmocele bei St.n. Sectio); Beurteilung Endometrium nach IETA (siehe Link unten); Beurteilung der Ovarien (Follikelpersistenz, PCO-like Ovarien, Adnextumore), anatomische Uterusanomalien, Hinweise auf Adenomyosis uteri
Hydrosonografie bei Vd.a. Polyp oder intrakavitäres Myom
Zytologie/invasive Diagnostik
Pipelle de Cornier
HSC/Curettage (Indikation siehe Grafik unten nach S3 Leitlinie Endometriumkarzinom 09/2022), ggf. Resektoskopie
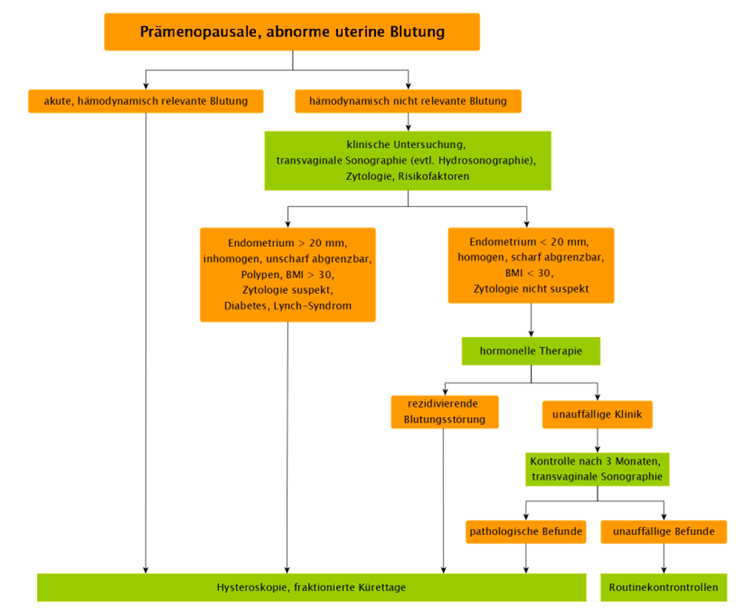
Abbildung 1: S3-Leitlinie Endometriumkarzinom Langversion (awmf.org), Stand 10.05.2023
Die optimale Therapiewahl bei AUB ist individuell und von zahlreichen Faktoren abhängig. Hierzu zählen neben der Ursache der Blutung, auch die Blutungsintensität, assoziierte Symptome, Kinderwunsch, Alter, Komorbiditäten und viele mehr.
Eine akute, hämodynamisch relevante Blutung verlangt in den meisten Fällen eine Therapie mittels Curettage.
Bei Vorliegen von «Red Flag»-Symptomen ist ebenfalls eine grosszügige Abklärung mittels HSC, Curettage zum Ausschluss einer Malignen Ursache empfohlen. Hierzu zählen:
- Persistierende intermenstruelle Blutungen, wenn > 45-jährig oder Risikofaktoren für Endometriumkarzinom (z.B. BMI >30, Tamoxifen-Therapie, Diabetes, Lynch-Syndrom)
- Therapieversagen bei > 45jährigen Patientinnen
- Sonographische Auffälligkeiten (z.B. > 20mm Dicke, inhomogen, unscharf begrenzt, etc.)
Ist die primäre Ätiologie bekannt, sollte diese, wenn möglich ursächlich angegangen werden.
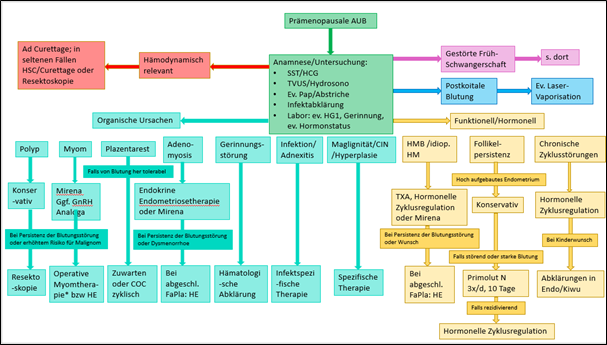
Strukturelle Ätiologien
Endometriumpolypen:
- Rate an malignen Polypen in postmenopausalen Patientinnen ist höher als in prämenopausalen Patientinnen (4.93% versus 1.12 %) und höher bei Patientinnen mit Polyp-bedingten Blutungsstörungen im Vergleich zu asymptomatischen Patientinnen (5.14% versus 1.89% in prämenopausalen Patientinnen und 4.47% versus 1.51% der postmenopausalen Patientinnen) (Uglietti et al., 2019, Lee et al., 2010)
- Trotzdem: Bei postmenopausalen Patientinnen: Hysteroskopische Polypresektion mit oder ohne Blutung
- Bei prämenopausalen Patientinnen: im Gesamtkontext beurteilen (Blutungsstörungen, Symptomatik, HCG etc.), ein Zuwarten und Kontrolle nach 1-4 Monaten postmenstruell ist meist gerechtfertigt.
- Bei störenden oder persistierenden Blutungsstörungen prämenopausal, a.e. durch den Polypen bedingt, ist ein operatives Vorgehen berechtigt; und anzustreben, wenn im Gesamtkontext (BMI, Familienanamnese (CAVE Lynch)) das Karzinom-Risiko individuell erhöht ist!
Uterus myomatosus mit Blutungsstörung und Familienplanung nicht abgeschlossen:
- Medikamentöse Optionen: Tranexamsäure, kombinierte Kontrazeptiva, Mirena ®-IUD, GnRH-Analoga (ggf. auch präoperativer Therapieversuch)
- Intrakavitäre Resektoskopie
- Myom-Embolisation
- Operatives Vorgehen, v.a. bei nicht therapierbaren Blutungsstörungen, abgeschlossener Familienplanung und/oder Wunsch der Patientin: Hysterektomie
Adenomyosis:
- Endokrine Endometriosetherapie oder Mirena
- Bei Therapieversagen und abgeschlossener Familienplanung: Hysterektomie
Restmaterial nach Abort/Interruptio:
- Sehr zurückhaltendes operatives Vorgehen, am besten abwartendes Vorgehen (mind. 4 Monate abwarten falls von Blutung tolerabel), ggf HCG-Kontrolle
- Evtl. regelmässige Blutungsauslösung mit COC in der Intervall-Einnahme
Ektopie:
- Ggf. Laserkoagulation
Funktionell/Hormonelle Ätiologien
Infektion:
- Therapie entsprechend Errgernachweis
Gerinnungsstörungen:
- Hämatologische Abklärung und Therapie in Rücksprache mit Hämatologen (z.B. Tranexamsäure, KOK, Mirena®-IUD, etc.)
Follikelpersistenz:
- Zuwarten
- Bei hochaufgebautem Endometrium (>5mm): Primolut N ® 5mg 1-1-1 für 10 Tage mit anschliessender Abbruchblutung (Patientin unbedingt hierüber aufklären!)
- Falls rezidivierend: hormonelle Zyklusregulation (Mirena®-IUD, KOK)
HMB (Heavy menstrual bleeding)/Idiopathische Hypermenorrhoe
(siehe auch Link HMB Endokrinologie: Heavy menstrual Bleeding (HMB) :: Obsgyn-Wiki):
- Nicht-hormonell: NSAR (z.B. Irfen 600mg 1-0-1 oder Mefenaminsäure 500mg 1-1-1), Tranexamsäure (Cyklokapron 1g 1-1-1, max. 5 Tage
- Levonorgestrel IUD (Mirena ®), kassenpflichtig bei idiopathischer Hypermenorrhoe
- Kombinierte orale Kontrazeptiva (v.a. Dienogest oder Nomegestrol z.B. Valette ®, Qlaira ®, Zoely ® nach Ausschluss Kontraindikationen entsprechend SGGG-Liste
- Progesteron-Only-Pill (Visanne ®)
Die Therapie mit Tamoxifen ist ein Risikofaktor für das Auftreten von Endometriumpolypen, -hyperplasie und auch -karzinomen.
Ein sonographisches Screening des Endometriums bei asymptomatischen Patientinnen unter Tamoxifen ist trotzdem nicht indiziert.
Eine AUB bei prämenopausalen Patientinnen unter Tamoxifen muss hingegen zwingend abgeklärt werden.
Typische Phänomene des Endometriums bei Tamoxifen-Einnahme im Ultraschall sind:
- Vakuolen
- Swiss-Cheese-Phänomen
- Hoch aufgebautes, vom Myometrium schwer abgrenzbares Endometrium
https://www.valeofyorkccg.nhs.uk/seecmsfile/?id=3382&inline=1
S3 Leitlinie Endometriumkarzinom 09/2022
Pennant, M.E., et al., Premenopausal abnormal uterine bleeding and risk of endometrial cancer. BJOG, 2017. 124(3): p. 404-411.
Wouk N, Helton M. Abnormal Uterine Bleeding in Premenopausal Women. Am Fam Physician. 2019; 99:435-443.
Clarke MA, Long BJ, Del Mar Morillo A, Arbyn M, Bakkum-Gamez JN, Wentzensen N. Association of Endometrial Cancer Risk With Postmenopausal Bleeding in Women: A Systematic Review and Meta-analysis. JAMA Intern Med. 2018 Sep 1;178(9):1210-1222. doi: 10.1001/jamainternmed.2018.2820. PMID: 30083701; PMCID: PMC6142981.
The role of transvaginal ultrasonography in evaluating the endometrium of women with postmenopausal bleeding. ACOG Commit- tee Opinion No. 734. American College of Obstetricians and Gynecologists. Obstet Gynecol 2018;131:e124–9.
Sheng Q, Yang J, Zhao Q, Li F. Dynamic monitoring of menopause hormone therapy and defining the cut-off value of endometrial thickness during uterine bleeding. J Biomed Res. 2016 May;30(3):191-6. doi: 10.7555/JBR.30.20150147. Epub 2016 Apr 10. PMID: 27533929; PMCID: PMC4885166.
Leone FPG, Timmerman D, Bourne T, Valentin L, Epstein E, Goldstein SR, et al. Terms, definitions and measurements to describe the sonographic features of the endometrium and intrauterine lesions: a consensus opinion from the International Endometrial Tumor Analysis (IETA) group. Ultrasound Obstet Gynecol. 2010:103–12.
Shaw E., Farris M., McNeil J., Friedenreich C. (2016) Obesity and Endometrial Cancer. In: Pischon T., Nimptsch K. (eds) Obesity and Cancer. Recent Results in Cancer Research, vol 208. Springer, Cham
https://doi.org/10.1007/978-3-319-42542-9_7
Kawachi A., Shimazu T., Budhathoki S., Sawada N., Yamaji T., Iwasaki M., Inoue M., Tsugane S. JPHC Study Group. Association of BMI and height with the risk of endometrial cancer, overall and by histological subtype: A population-based prospective cohort study in Japan. Eur. J. Cancer Prev. 2018 doi: 10.1097/CEJ.0000000000000449
Uglietti A, Buggio L, Farella M, Chiaffarino F, Dridi D, Vercellini P, Parazzini F. The risk of malignancy in uterine polyps: A systematic review and meta-analysis. Eur J Obstet Gynecol Reprod Biol. 2019; 237:48-56. doi: 10.1016/j.ejogrb.2019.04.009. Epub 2019 Apr 15.
Lee SC, Kaunitz AM, Sanchez-Ramos L, et al. The oncogenic potential of endometrial polyps: a systematic review and meta-analysis. Obstet Gynecol. 2010;116:1197–1205.
Braithwaite, R.S., et al., Meta-analysis of vascular and neoplastic events associated with tamoxifen. J Gen Intern Med, 2003. 18(11): p. 937-47.
Al-Mubarak, M., et al., Extended adjuvant tamoxifen for early breast cancer: a meta-analysis. PLoS One, 2014. 9(2): p. e88238.
DeMichele, A., et al., Impact of raloxifene or tamoxifen use on endometrial cancer risk: a population-based case-control study. J Clin Oncol, 2008. 26(25): p. 4151-9.
Saccardi, C., et al., Endometrial surveillance in tamoxifen users: role, timing and accuracy of hysteroscopic investigation: observational longitudinal cohort study. Endocr Relat Cancer, 2013. 20(4): p. 455-62.
Stute P, von Wolff M. Prämenopausale Blutungsstörungen. Gynäkologie 3/2013.
Römer R. Postmenopausale Blutungsstörungen. Gynäkologie 3/2013.
SGUMGG: Empfehlungen zur Ultraschalluntersuchung in der Gynäkologie (2. Auflage)
AWMF. S3-Leitlinie Diagnostik, Therapie und Nachsorge der Patientinnen mit Endometriumkarzinom
Wouk N, Helton M. Abnormal Uterine Bleeding in Premenopausal Women. American Family Physician. Volume 99, Number 7, April 1, 2019
Autor: Dr. S. Verta
Autorisiert: Dr. S. Verta
Version: 14.06.2023
Gültig bis: 14.06.2024
